肝炎病毒
肝炎病毒,包括甲型、乙型、丙型、丁型和戊型,通过诱发肝炎对全球健康构成威胁。甲型和戊型通常通过受污染的食物和水传播,而乙型、丙型和丁型则通过受感染的血液和体液传播。这些病毒可能导致急性或慢性肝病,其中乙型和丙型肝炎往往悄无声息地发展为慢性疾病,增加了肝硬化和肝癌的风险。除了乙型肝炎病毒(HBV)外,所有这些肝炎病毒都是RNA病毒。针对甲型和乙型肝炎的疫苗可用于预防。
表1. 肝炎病毒的特征
| 甲型肝炎病毒 (HAV) | 乙型肝炎病毒 (HBV) | 丙型肝炎病毒 (HCV) | 丁型肝炎病毒 (HDV) | 戊型肝炎病毒 (HEV) | |
|---|---|---|---|---|---|
| 病毒科 | Picornaviridae | Hepadnaviridae | Flaviviridae | 不适用 | Hepeviridae |
| 病毒属 | Hepatovirus | Orthohepadnavirus | Hepacivirus | Deltavirus | Orthohepevirus |
| 基因组 | 正链单链线性RNA | 双链DNA | 正链单链线性RNA | 负链单链环状RNA | 正链单链线性RNA |
| 传播方式 | 粪-口 | 接触受感染血液或体液/性/围生期 | 接触受感染血液 | 接触受感染血液/体液 | 粪-口/动物源/输血 |
| 感染的临床结果 | 自限性 | 自限性和慢性 | 自限性和慢性 | 自限性和慢性 | 自限性 |
表格信息引用自: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8999150/
甲型肝炎病毒(HAV)
HAV是一种无包膜的RNA病毒,基因组大小为7.5 kb。其基因组编码一个单一的大型多聚蛋白,经过处理后形成四个衣壳蛋白(VP1、VP2、VP3、VP4)和七个非结构多肽(2A、2B、2C、3A、3B、3C、3D)。传染性HAV病毒存在于两种形式:裸露的无包膜HAV(neHAV)病毒颗粒,以及通过劫持宿主控制产生的准包膜病毒(eHAV)。
| HAV蛋白 | 功能 | 产品 | ||
|---|---|---|---|---|
| 基因组多聚蛋白 | 结构蛋白 | VP1 | 构成衣壳多肽 | Recombinant Human HAV genotype IA Genome polyprotein |
| VP2 | Recombinant Human HAV genotype IIA Genome polyprotein | |||
| VP3 | Recombinant Human HAV genotype IIIA Genome polyprotein | |||
| VP4 | ||||
| 非结构蛋白 | 2A | 病毒复制所需 | Recombinant Human HAV genotype IB Genome polyprotein | |
| 2B | ||||
| 2C | Recombinant Human HAV genotype IIB Genome polyprotein | |||
| 3A | 将复制成分锚定到细胞膜 | |||
| 3B | 也称为VPg | Recombinant Human HAV genotype IIIB Genome polyprotein | ||
| 3C | 一种半胱氨酸蛋白酶,将多肽切割成蛋白质 | |||
| 3D | 一种RNA聚合酶 | |||
HAV生命周期
HAV通过与细胞表面分子(特别是唾液酸和神经节苷脂)结合进入宿主肝细胞,随后病毒衣壳脱落,病毒RNA从内质网释放到细胞质中 [1]。病毒基因组在内部核糖体进入位点(IRES)的调控下被翻译成多聚蛋白,然后被切割成不同的结构和非结构蛋白。
基因组RNA也被用作模板,生成许多新的RNA基因组副本,这些副本被包装成衣壳以产生细胞内病毒后代。新合成的HAV病毒颗粒以准包膜形式从细胞中释放。
乙型肝炎病毒(HBV)
HBV病毒颗粒由外层脂蛋白包膜组成,包膜由乙型肝炎表面抗原(HBsAg)构成,以及由乙型肝炎核心抗原(HBcAg)形成的二十面体核衣壳,包裹着部分双链、松弛环状DNA(rcDNA)基因组,基因组大小为3.2 kb。
HBV基因组由四个部分重叠的开放阅读框(ORFs)组成,分别为C(核心)、P(聚合酶)、X(调节X蛋白)和S(表面),从中合成七种功能性蛋白:HBcAg、HBeAg、聚合酶(pol)、HBx和三种类型的HBsAg - 小型(s)、中型(M)和大型(L)蛋白。
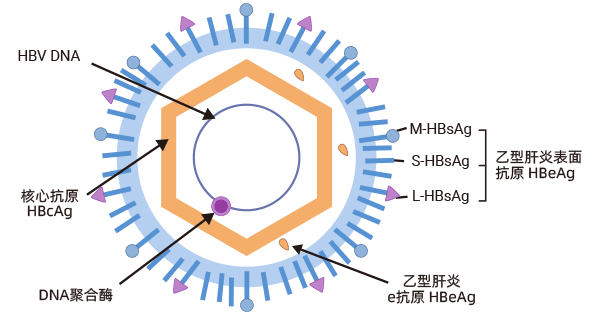
图1. 乙型肝炎病毒的结构
图片来自维基百科
HBV生命周期
HBV以依赖内吞作用的方式进入宿主肝细胞。HBV首先通过与肝细胞表面的硫酸肝素蛋白多糖(HSPGs)如glypican 5结合开始。然后,它与肝细胞表面的钠牛磺胆酸共转运肽(NTCP/SLC10A1)受体结合以引发病毒内化 [2-4]。
研究表明,EGFR通过与NTCP直接相互作用触发HBV进入宿主细胞 [5,6]。随后,病毒核衣壳被释放到肝细胞质中,然后被运输到细胞核。
在细胞核中,病毒基因组rcDNA被转换成cccDNA(共价闭合环状DNA),以扩增病毒RNA中间体,然后再次逆转录回病毒DNA [7]。同时,病毒DNA整合到宿主基因组中,这是乙型肝炎无法治愈的原因。
cccDNA微型染色体保留在细胞核中,作为病毒RNA转录的模板。它编码七种必需的病毒蛋白,用于复制:三种不同大小的HBsAg、HBcAg、HBeAg、HBx和DNA聚合酶 [8]。
在细胞质中,HBcAg蛋白自组装成二十面体核衣壳,包裹病毒聚合酶和pgRNA。在核衣壳内进行逆转录后,包含HBV基因组的病毒衣壳与内质网中的HBsAg蛋白结合进行包裹。最终,成熟的HBV病毒颗粒通过多泡体(MVBs)从肝细胞中释放。
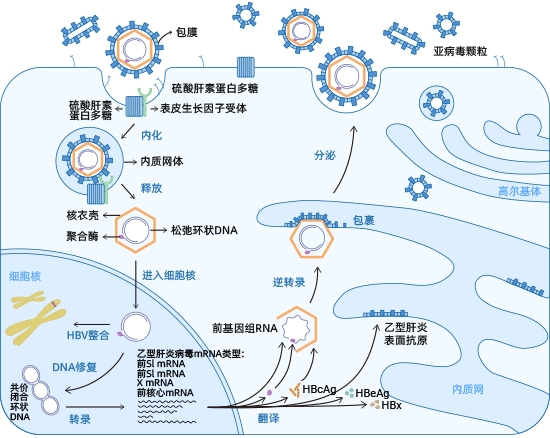
图2. HBV生命周期
图源: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8387624/
丙型肝炎病毒(HCV)
HCV的RNA基因组长度约为9.6 kb。病毒基因组包含一个单一的开放阅读框(ORF),编码一个单一的多聚蛋白前体,随后被处理成三个结构蛋白和七个非结构蛋白。
HCV生命周期
HCV以pH和clathrin依赖的内吞作用进入细胞。HCV首先通过与HSPG和LDL-R结合附着到宿主细胞,然后通过E2与肝细胞表面的CD81和清道夫受体类B型I(SR-BI)结合 [9,10],并通过与claudin-1和occludin相互作用,促进其与内质网膜融合,从而进入细胞 [11]。
随后,内质网介导的内化作用,内质网酸化促进低pH依赖的HCV包膜与内质网膜融合,导致病毒基因组RNA释放到细胞质中 [12]。RNA被用作复制和多聚蛋白翻译的模板。RNA翻译在ER中进行,并由5'UTR IRES与核糖体结合启动,导致形成多聚蛋白前体。
多聚蛋白在宿主或病毒蛋白酶的作用下共同翻译后和翻译后被切割,产生结构蛋白(核心蛋白、E1和E2)和非结构蛋白(p7、NS2、NS3、NS4A、NS4B、NS5A和NS5B蛋白)。HCV RNA复制发生在内质网中的膜网(MW)内,并由NS5B RNA依赖RNA聚合酶催化。新生成的病毒RNA被运输到核心蛋白组装位点,然后被包裹形成核衣壳。
病毒核衣壳随后与病毒E1/E2蛋白(包裹)相互作用,并进入ER腔,然后被转移到高尔基体。病毒病毒在高尔基体中完成成熟,并通过极低密度脂蛋白(VLDL)途径从宿主肝细胞中运输并释放。
丁型肝炎病毒(HDV)
Rizzetto等人最初在1977年在HBV感染的严重肝炎患者中发现了HDV [13]。HDV是一种混合病毒,因为它使用乙型肝炎表面抗原(HBsAg)作为其包膜蛋白。这一特性使得HDV只能感染同时携带HBV的患者。
HDV颗粒由外层脂蛋白包膜组成,由HBV的表面抗原(HBsAg)构成,内部为核糖核蛋白结构,其中包含HDV基因组。HDV基因组约为1.7 kb,仅编码肝炎δ抗原(HDAg),有两种形式:27 kDa大HDAg(delta-Ag-L)和24 kDa小HDAg(delta-Ag-S)[14]。
| HDV蛋白 | 功能 | 产品 |
|---|---|---|
| Large delta antigen (L-HDAg) | 对病毒组装至关重要 | Recombinant HDV Large delta antigen |
| Recombinant HDV genotype I Large delta antigen | ||
| Recombinant HDV genotype II Large delta antigen | ||
| Recombinant HDV genotype III Large delta antigen | ||
| Small delta antigen (S-HDAg) | 维持HDV RNA复制所需 | Recombinant HDV genotype I Small delta antigen |
| Recombinant HDV genotype II Small delta antigen | ||
| Recombinant HDV genotype III Small delta antigen |
HDV生命周期
HDV感染依赖于HBV的存在,因为它需要HBV的包膜蛋白才能进入、组装和传播。HDV病毒最初附着在肝细胞表面的HSPGs上,然后通过NTCP受体进入宿主细胞 [15]。病毒包膜与内质网膜融合后,HDV核糖核蛋白(RNP)从内质网中释放出来,然后被运输到细胞核。
在细胞核内,HDV RNA通过双滚动圈扩增机制进行复制,生成抗原体RNA和额外的基因组RNA。出口到细胞质后,mRNA在ER处被翻译以生成HDAg蛋白。HDAg蛋白随后重新进入细胞核,其中S-HDAg增强基因组复制。S-HDAg和L-HDAg与新合成的基因组RNA结合形成新的RNP。
产生的RNP被释放到细胞质中,其中L-HDAg有助于与ER中的HBsAg连接,组装新的病毒颗粒。新合成的病毒颗粒随后通过高尔基体从肝细胞中释放,以感染相邻细胞。
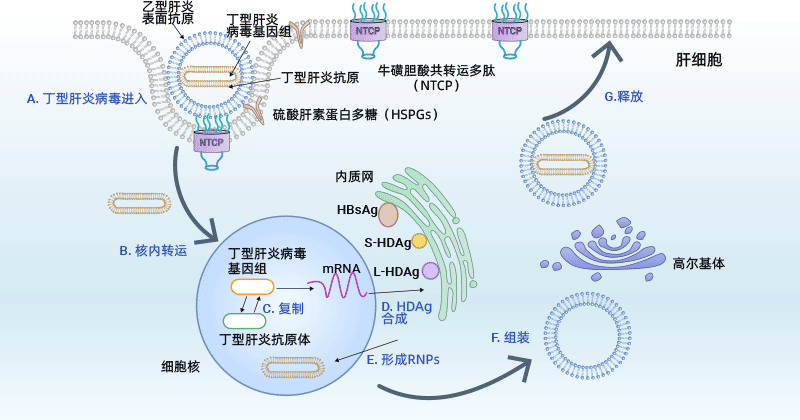
图3. HDV生命周期
图源: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8557527/
戊型肝炎病毒(HEV)
与HAV类似,HEV病毒在感染宿主中以两种形式存在,粪便中的非包膜(neHEV)球形颗粒和循环血液中的准包膜(eHEV)颗粒以及感染细胞培养物的上清液。
HEV基因组RNA长度约为7.2 kb,具有三个开放阅读框(ORFs):ORF1编码非结构多聚蛋白,用于病毒复制和转录,ORF2编码衣壳蛋白,具有高度免疫原性并引发中和抗体,ORF3部分重叠ORF2,编码参与病毒形态形成和致病性的多功能磷蛋白。
最近,仅在基因型1 HEV中发现了一个新的ORF4,内质网(ER)应激通过促进基因型1 HEV中新ORF4的翻译来促进病毒复制 [16]。
| HEV蛋白 | 功能 | 产品 |
|---|---|---|
| ORF1 | 编码非结构多聚蛋白,用于病毒复制和转录 | Recombinant HEV genotype 1 Non-structural polyprotein pORF1 (ORF1) |
| Recombinant HEV genotype 3 Non-structural polyprotein pORF1 (ORF1) | ||
| Recombinant HEV genotype 4 Non-structural polyprotein pORF1 (ORF1) | ||
| ORF2 | 编码衣壳结构蛋白,高度免疫原性并引发中和抗体 | Recombinant HEV Capsid protein (ORF2) |
| Recombinant HEV genotype 1 Secreted protein ORF2 | ||
| Recombinant HEV genotype 3 Capsid protein (ORF2) | ||
| Recombinant HEV genotype 4 Capsid protein (ORF2) | ||
| ORF3 | 编码多功能磷蛋白,具有两个疏水结构域(D1和D2)和两个富含脯氨酸的结构域(P1和P2) | Recombinant HEV genotype 1 Protein ORF3 |
| Recombinant HEV genotype 3 Protein ORF3 | ||
| Recombinant HEV genotype 4 Protein ORF3 | ||
| ORF4 | 仅在基因型1 HEV中鉴定 | / |
HEV生命周期
HEV感染始于个体摄入粪便污染的水或食物,将病毒引入消化系统。HEV随后通过病毒血症进入血液并到达肝脏。非包膜HEV颗粒附着在肝细胞表面的HSPGs上,并通过特定细胞受体进入宿主细胞。准包膜HEV病毒通过依赖于dynamin的、介导的clathrin内吞作用进入肝细胞,涉及Rab5和Rab7。
进入宿主肝细胞后,HEV颗粒经历衣壳蛋白脱落,然后将其基因组RNA释放到细胞质中。病毒基因组RNA直接作为mRNA用于ORF1多聚蛋白的翻译。它还合成互补的负义RNA,作为转录基因组和亚基因组mRNA的模板。
亚基因组mRNA随后被翻译成ORF2衣壳蛋白和ORF3多功能磷蛋白。ORF2衣壳蛋白形成病毒样颗粒(VLPs),并包装新合成的正义基因组RNA以产生后代HEV病毒。
ORF3通过与细胞蛋白相互作用调节宿主环境,促进病毒复制和释放。值得注意的是,ORF3与ESCRT途径中的TSG101结合,帮助新生病毒颗粒出芽到多泡体中。这些多泡体与质膜融合,从感染的肝细胞中释放病毒病毒,要么作为eHEV进入血液,要么作为neHEV进入胆管。
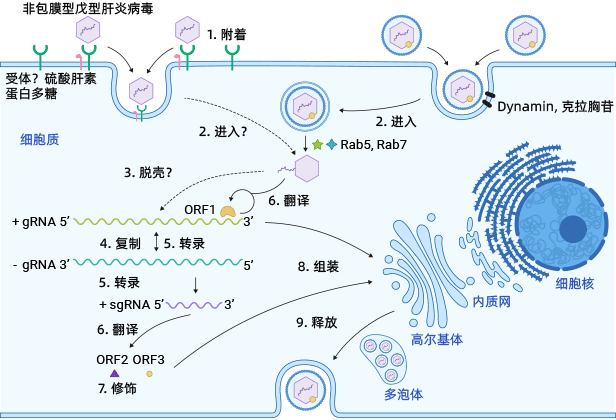
图3. HEV生命周期
图源: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8079827/
全球肝炎病毒状况
肝炎病毒的全球状况仍然是一个重要的公共卫生问题。特别是乙型和丙型肝炎,由于它们能够引起慢性感染并导致严重的肝病,因此构成了持续的挑战。有效的抗病毒治疗和疫苗接种计划的发展在预防和管理肝炎感染方面取得了进展。然而,获取的障碍,特别是在低收入地区,仍然存在。
参考文献:
[1] Gholizadeh O, Akbarzadeh S, et al. Hepatitis A: Viral Structure, Classification, Life Cycle, Clinical Symptoms, Diagnosis Error, and Vaccination [J]. Can J Infect Dis Med Microbiol. 2023 Jan 4;2023:4263309.
[2] A. Schulze, P. Gripon, and S. Urban. Hepatitis B virus infection initiates with a large surface protein-dependent binding to heparan sulfate proteoglycans [J]. Hepatology, 46 (2007), pp. 1759-1768.
[3] E.R. Verrier, C.C. Colpitts, et al. A targeted functional RNA interference screen uncovers glypican 5 as an entry factor for hepatitis B and D viruses [J]. Hepatology, 63 (2016), pp. 35-48.
[4] H. Yan, G. Zhong, eet al. Sodium taurocholate cotransporting polypeptide is a functional receptor for human hepatitis B and D virus [J]. Elife, 1 (2012), Article e00049.
[5] M. Iwamoto, W. Saso, et al. Epidermal growth factor receptor is a host-entry cofactor triggering hepatitis B virus internalization [J]. Proc. Natl. Acad. Sci. U. S. A., 116 (2019), pp. 8487-8492.
[6] Seeger C, Mason WS. Molecular Biology of Hepatitis B Virus Infection [J]. Virology (2015) 479-480:672–86.
[7] Schreiner S, Nassal M. A Role for the Host DNA Damage Response in Hepatitis B Virus cccDNA Formation-And Beyond [J]? Viruses (2017) 9(5):125.
[8] Tong S, Revill P. Overview of Hepatitis B Viral Replication and Genetic Variability [J]. J Hepatol (2016) 64(1 Suppl):S4–16.
[9] Molina S, Castet V, Pichard-Garcia L, et al. Serum-derived hepatitis C virus infection of primary human hepatocytes is tetraspanin CD81 dependent [J]. Journal of Virology. 2008;82:569-574.
[10] Scarselli E, Ansuini H, Cerino R, et al. The human scavenger receptor class B type I is a novel candidate receptor for the hepatitis C virus [J]. The EMBO Journal. 2002;21:5017-5025.
[11] Liu S, Yang W, Shen L, et al. Tight junction proteins claudin-1 and occludin control hepatitis C virus entry and are downregulated during infection to prevent superinfection [J]. Journal of Virology. 2009;83:2011-2014.
[12] Tscherne DM, Jones CT, et al. Time- and temperature-dependent activation of hepatitis C virus for low-pH-triggered entry [J]. J Virol. 2006;80:1734-1741.
[13] Rizzetto M, Canese MG, et al. Immunofluorescence detection of new antigen-antibody system (delta/anti-delta) associated to hepatitis B virus in liver and in serum of HBsAg carriers [J]. Gut. 1977;18(12):997–1003.
[14] Weiner AJ, Choo QL, et al. A single antigenomic open reading frame of the hepatitis delta virus encodes the epitope(s) of both hepatitis delta antigen polypeptides p24 delta and p27 delta [J]. J Virol. 1988;62(2):594–9.
[15] Li J, Wands J. Hepatitis B and D viral receptors [J]. Hepatology. 2016;63(1):11–3.
[16] V.P. Nair, S. Anang, C. Subramani, A. Madhvi, K. Bakshi, A. Srivastava, et al. Endoplasmic Reticulum Stress Induced Synthesis of a Novel Viral Factor Mediates Efficient Replication of Genotype-1 Hepatitis E Virus [J]. PLoS Pathog, 12 (2016), Article e1005521.






