【29期】前沿靶点速递:每周医学研究精选
日期:2025-02-25 16:44:33
01.靶点:FAM171A2
应用:帕金森病全新治疗靶点
来源:Neuronal FAM171A2 mediates α-synuclein fibril uptake and drives Parkinson's disease.Science,2025 Feb 21
复旦大学附属华山医院郁金泰团队通过 5 年临床和基础研究,首次发现帕金森病全新治疗靶点 FAM171A2,并找到具有潜在治疗作用的小分子化合物,研究成果发表于《科学》期刊。研究揭示 FAM171A2 蛋白与帕金森病关键致病蛋白 α - 突触核蛋白的结合机制,FAM171A2 会选择性结合病理性 α - 突触核蛋白并将其带入神经元内,导致神经元死亡和病理蛋白传播。转基因动物实验显示敲除 FAM171A2 可控制帕金森样症状进展。团队利用人工智能技术从 7000 余种小分子化合物中筛选出能抑制二者结合的化合物,并申请相关国际专利,计划开展临床前研发工作,有望实现帕金森病病因治疗与症状缓解双重突破,为其他神经退行性疾病治疗提供借鉴。
02.靶点:METTL1
应用:脂肪肉瘤(Liposarcoma)的潜在治疗靶点
来源:A methyltransferase-independent role for METTL1 in tRNA aminoacylation and oncogenic transformation.Mol Cell,2025 Jan 28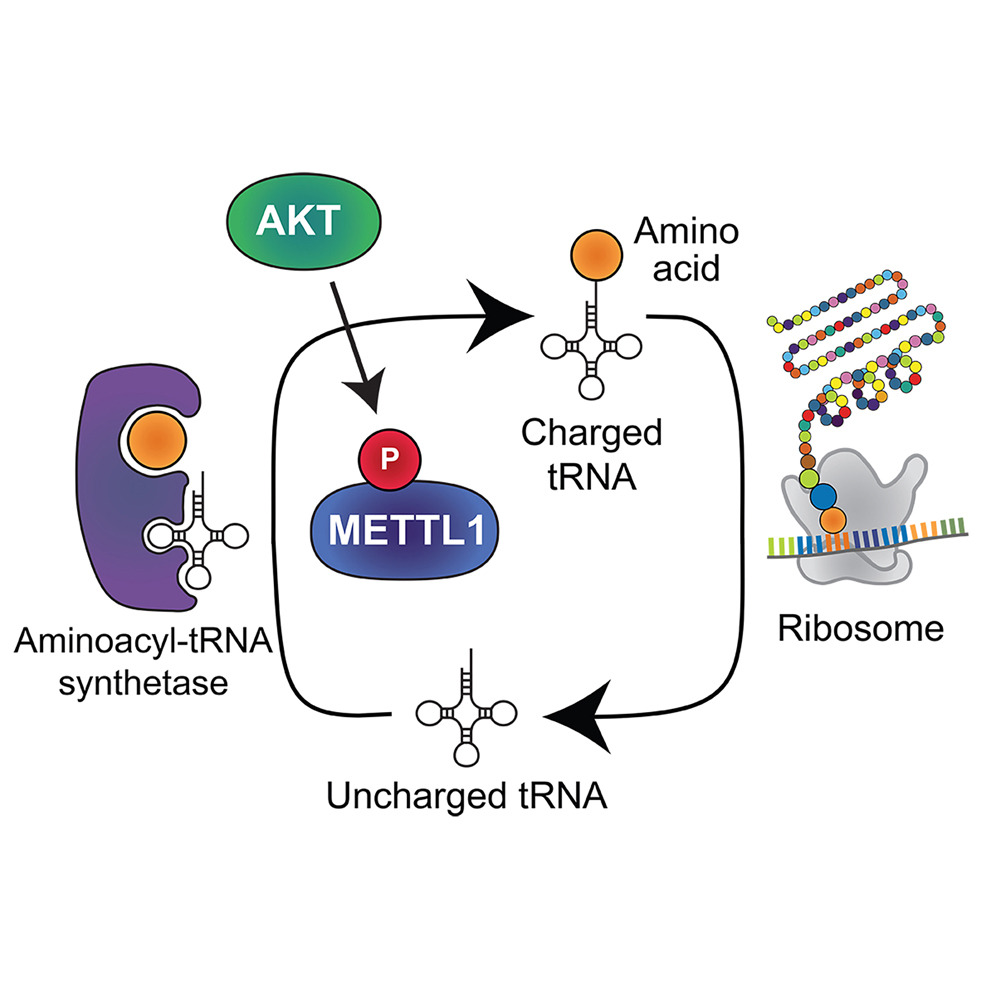
近期,Alejandro Gutierrez团队在《Molecular Cell》发表的研究揭示了脂肪肉瘤中关键致癌基因METTL1的非传统作用机制。研究表明,染色体12q13-15扩增通过驱动METTL1过表达促进肿瘤发生,且其致癌功能与甲基转移酶活性无关。实验发现,METTL1的磷酸化形式(S27D)或催化失活突变体能同样激活AKT信号并诱导肉瘤形成,颠覆了此前认为AKT通过磷酸化抑制METTL1活性的认知。机制上,METTL1通过结合多tRNA合成酶复合物,促进tRNA氨基化修饰及蛋白质合成,增强多聚核糖体形成,从而驱动肿瘤细胞增殖。值得注意的是,METTL1扩增的脂肪肉瘤对放线菌素D(核糖体合成抑制剂)高度敏感,提示靶向蛋白质合成通路可能成为有效治疗策略。该研究不仅重新定义了METTL1在癌症中的核心功能,还为开发新型靶向疗法提供了关键分子依据。
03.靶点:CNDP2
应用:肥胖及相关代谢疾病的潜在治疗靶点
来源:A β-hydroxybutyrate shunt pathway generates anti-obesity ketone metabolites.Cell,2025 Jan 09
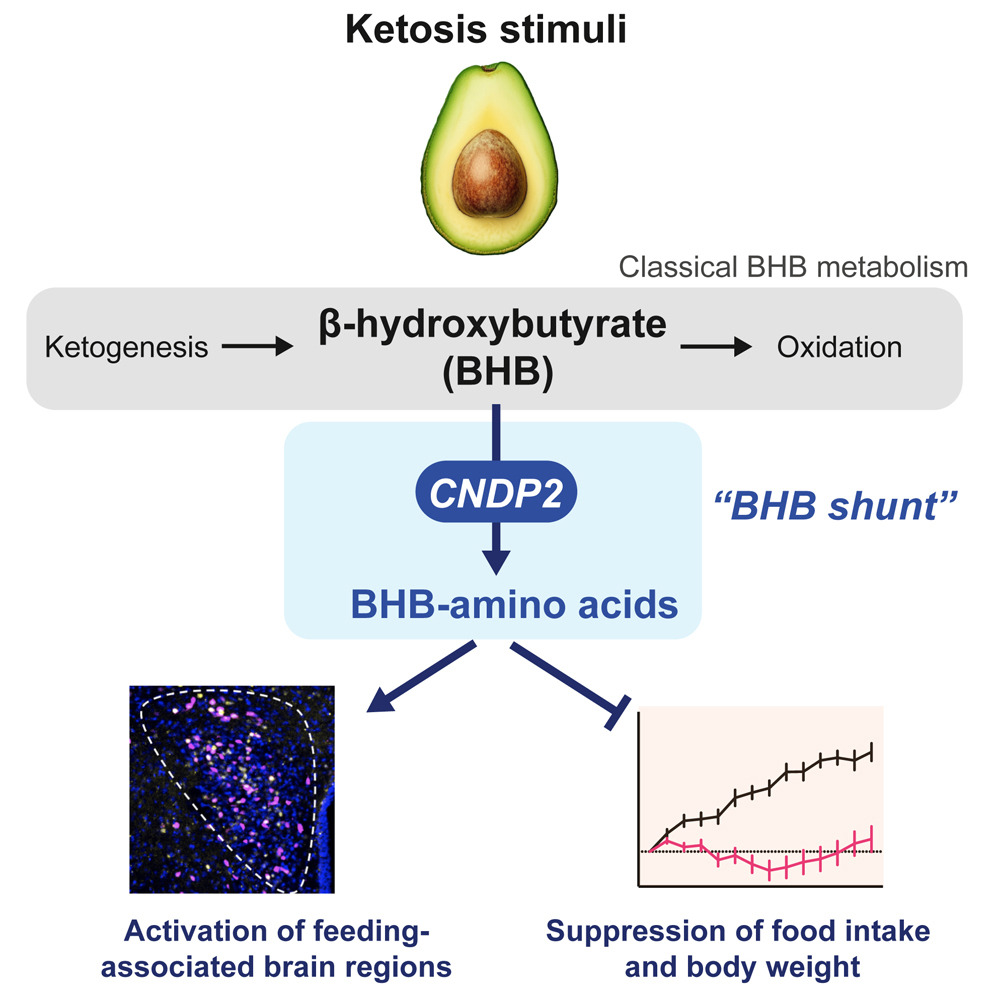
本研究揭示了CNDP2介导的β-羟基丁酸(BHB)次级代谢途径在抗肥胖中的关键作用。研究发现,CNDP2通过酶促反应将BHB与游离氨基酸(如苯丙氨酸)结合,生成具有显著抗肥胖活性的代谢物BHB-氨基酸复合物,其中以BHB-Phe(BHB与苯丙氨酸的结合物)最为丰富。这类代谢物能够特异性激活下丘脑和脑干神经元,抑制食欲并减少食物摄入。实验进一步验证,在小鼠模型中敲除CNDP2基因会降低BHB-氨基酸水平,导致摄食量增加和体重上升;而补充BHB-Phe可有效逆转这一现象。值得注意的是,该代谢途径在人类中高度保守,提示其可能通过调控能量平衡和食欲中枢参与跨物种的体重管理。本研究不仅拓展了BHB在代谢调控中的新功能,还揭示了CNDP2作为潜在靶点在开发肥胖及相关代谢疾病治疗策略中的重要性。
04.靶点:ZDHHC2
应用:结核病的潜在治疗靶点
来源:ZDHHC2 promoted antimycobacterial responses by selective autophagic degradation of B-RAF and C-RAF in macrophages.Sci Adv,2025 Jan 24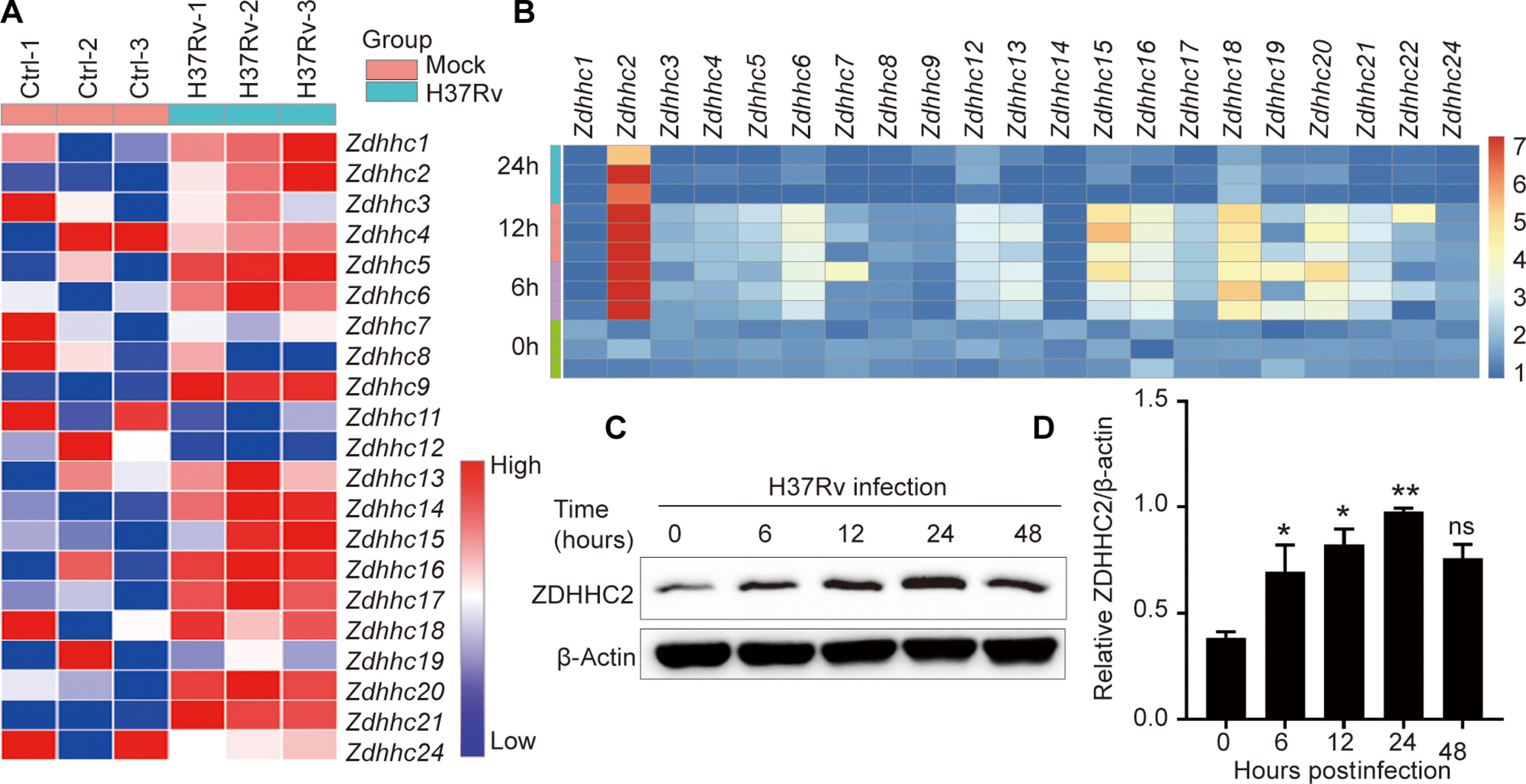
本研究发现,结核分枝杆菌感染可诱导小鼠巨噬细胞中锌指DHHC结构域型棕榈酰转移酶(ZDHHC)的表达,尤其是ZDHHC2。ZDHHC2的缺失会削弱巨噬细胞对结核菌的免疫防御能力,降低促炎细胞因子的产生。机制上,ZDHHC2通过介导B-RAF和C-RAF的棕榈酰化,影响其自噬降解,稳定蛋白水平,进而增强ERK信号通路活性,影响结核菌在巨噬细胞内的存活。该研究揭示了ZDHHC2在结核感染中的关键作用,并为结核病治疗提供了潜在靶点。
05.靶点:Casz1
应用:针对感音性耳聋(sensorineural hearing loss)的潜在治疗靶点
来源:Casz1 is required for both inner hair cell fate stabilization and outer hair cell survival.Science,2025 Jan 30
《Science》近期发表的研究揭示了锌指转录因子Casz1在听觉毛细胞(HC)命运稳定与生存维持中的双重作用。研究发现,Casz1在内毛细胞(IHC)中高表达,维持其命运稳定,防止其转变为外毛细胞(OHC);而在OHC中,Casz1短暂表达以维持其存活。Casz1缺失会导致IHC命运不稳定并转变为OHC,同时OHC存活受损,最终导致听力障碍。通过单细胞转录组分析和遗传学回补实验,研究人员发现Gata3是Casz1的关键下游效应分子,Tbx2则对Casz1具有上位调控作用。该研究为听觉毛细胞再生和纤毛功能恢复提供了潜在的基因治疗靶点,有望推动听觉损伤基因治疗的发展。
06.靶点:PELO
应用:携带FOCAD或TTC37突变癌症的潜在抗癌靶点
来源:SKI complex loss renders 9p21.3-deleted or MSI-H cancers dependent on PELO.Nature,2025 Feb 05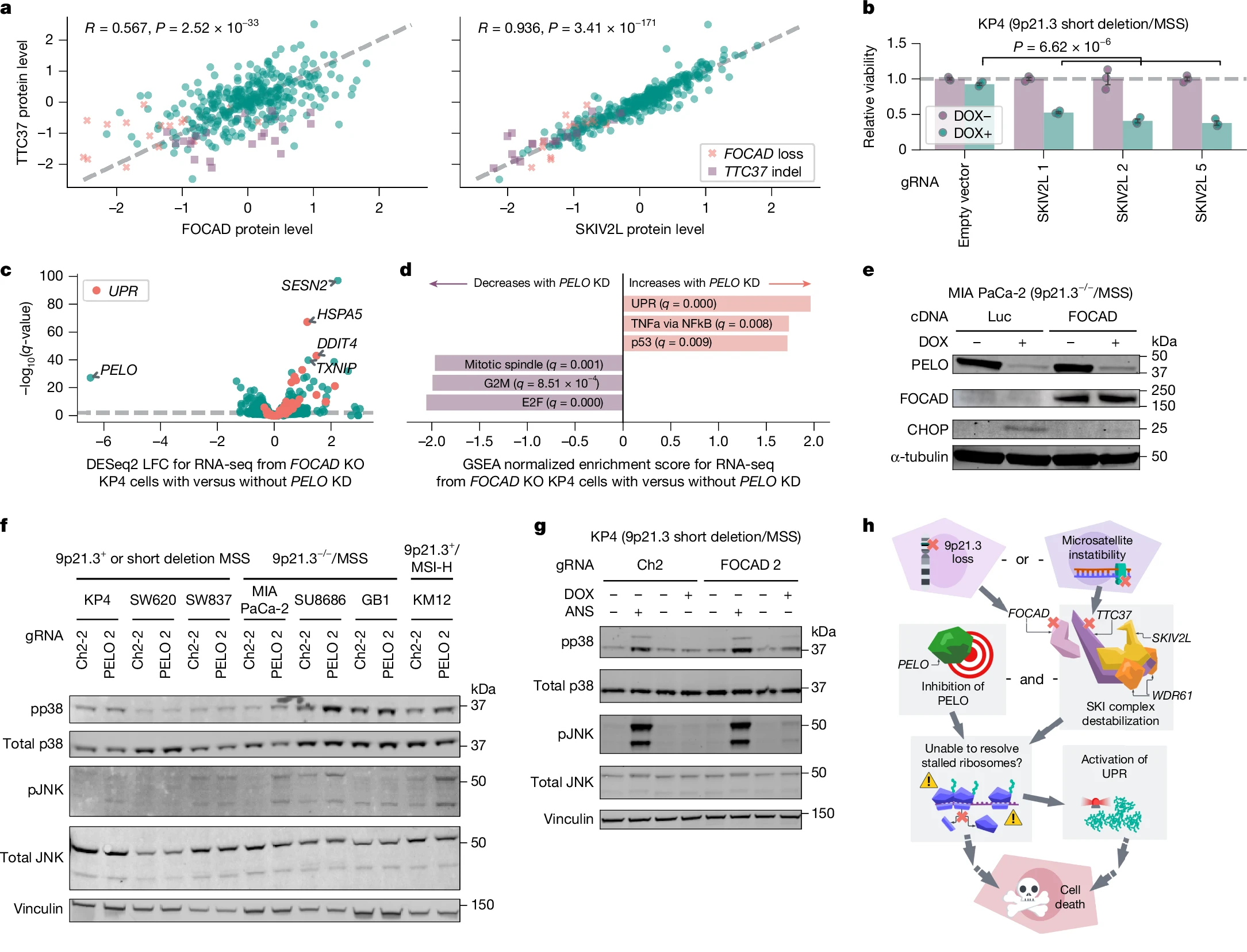
Broad研究所和哥伦比亚大学的研究团队在《Nature》杂志上发表研究,发现PELO基因是约5%成人癌症的潜在抗癌靶点。研究显示,FOCAD或TTC37基因突变的癌细胞严重依赖PELO存活,PELO失活可杀死这些癌细胞。FOCAD和TTC37是“超级杀伤复合体”的一部分,参与从停滞核糖体中提取RNA,而PELO负责重启核糖体。当FOCAD和TTC37突变时,细胞依赖PELO来恢复蛋白质生产,否则会死亡。这一发现为合成致死领域提供了新思路,有望开发针对PELO的靶向药物,为携带FOCAD或TTC37突变的癌症患者提供新的治疗选择。
07.靶点:YAP
应用:HPV阳性的头颈部鳞状细胞癌(HNSC)等的潜在治疗靶点
来源:YAP-driven malignant reprogramming of oral
epithelial stem cells at single cell resolution.Nat Commun,2025 Jan 08
加州大学圣地亚哥分校的研究团队在《自然-通讯》发表研究,揭示了人乳头瘤病毒(HPV)与转录因子YAP共同作用加速口腔癌发生的新机制。研究发现,HPV的E6和E7促癌蛋白可抑制肿瘤抑制因子,而YAP在口腔上皮祖细胞中异常激活,促使细胞向癌细胞转变,并增加细胞的移动性和侵袭性。在HNSC小鼠模型中,YAP与HPV E6、E7蛋白的共同激活可迅速诱导口腔肿瘤发生,例如小鼠舌部在8天内即可出现肿瘤病变。此外,YAP激活的细胞还会招募并重编程髓系免疫细胞,帮助肿瘤免疫逃逸。研究指出,YAP可能是HPV阳性口腔癌的潜在治疗靶点,团队正在探索阻断YAP功能的药物,如二甲双胍,并开展临床试验验证其效果。
08.靶点:ALKBH5
应用:钙化性主动脉瓣疾病(CAVD)、结直肠癌(CRC)等潜在治疗靶点
来源:The N6-methyladenosine demethylase ALKBH5 is a novel epigenetic regulator of aortic valve calcification.Cardiovasc Res,2024 Dec 10
09.靶点:PRDX6
应用:卵巢癌等疾病潜在治疗靶点
来源:PRDX6 Prevents NNMT Ubiquitination and Degradation as a Nonenzymatic Mechanism to Promote Ovarian Cancer Progression.Adv Sci (Weinh),2025 Jan 30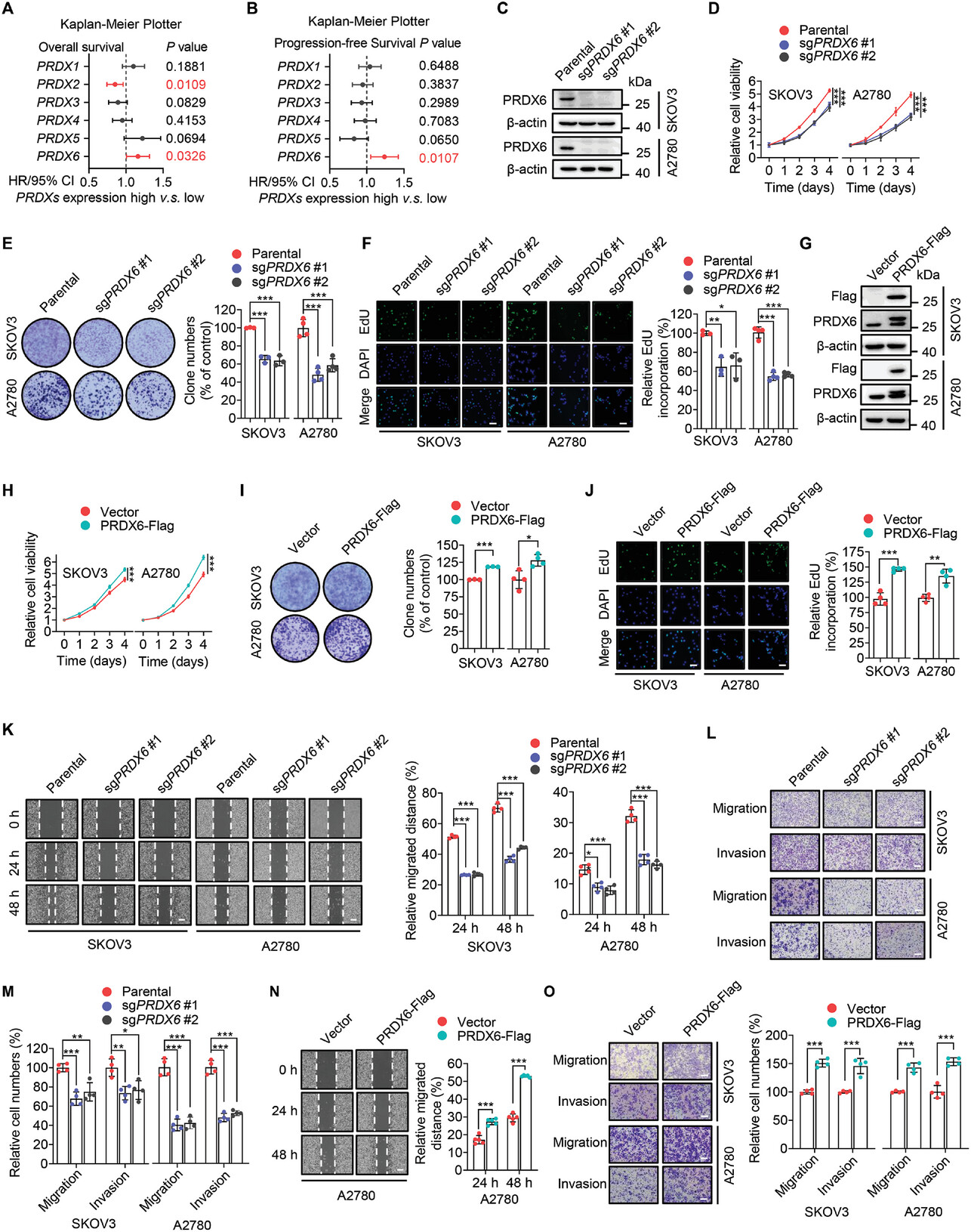
四川大学华西基础医学与法医学院王魁团队在《Advanced Science》发表研究,揭示了抗氧化酶PRDX6在卵巢癌进展中的非酶活促癌机制。研究发现,PRDX6高表达与卵巢癌患者预后不良相关,且其通过非酶活功能与NNMT竞争性互作,抑制TRIM56介导的NNMT泛素化和蛋白酶体降解,进而上调NNMT蛋白水平。这一过程激活了MAPK信号通路,促进了卵巢癌细胞的生长和转移。在小鼠模型中,PRDX6过表达显著促进肿瘤进展,而NNMT敲低则抑制了这一效应。临床样本分析显示,PRDX6和NNMT的高表达与卵巢癌患者预后更差相关。该研究为卵巢癌治疗提供了新的潜在靶点。
推荐产品
参考文献
*免责声明:华美生物内容团队仅是分享和解读公开研究论文及其发现,本文仅作信息交流,文中观点不代表华美生物立场,请理解。
应用:帕金森病全新治疗靶点
来源:Neuronal FAM171A2 mediates α-synuclein fibril uptake and drives Parkinson's disease.Science,2025 Feb 21

图源:10.1126/science.adp3645[1]
复旦大学附属华山医院郁金泰团队通过 5 年临床和基础研究,首次发现帕金森病全新治疗靶点 FAM171A2,并找到具有潜在治疗作用的小分子化合物,研究成果发表于《科学》期刊。研究揭示 FAM171A2 蛋白与帕金森病关键致病蛋白 α - 突触核蛋白的结合机制,FAM171A2 会选择性结合病理性 α - 突触核蛋白并将其带入神经元内,导致神经元死亡和病理蛋白传播。转基因动物实验显示敲除 FAM171A2 可控制帕金森样症状进展。团队利用人工智能技术从 7000 余种小分子化合物中筛选出能抑制二者结合的化合物,并申请相关国际专利,计划开展临床前研发工作,有望实现帕金森病病因治疗与症状缓解双重突破,为其他神经退行性疾病治疗提供借鉴。
02.靶点:METTL1
应用:脂肪肉瘤(Liposarcoma)的潜在治疗靶点
来源:A methyltransferase-independent role for METTL1 in tRNA aminoacylation and oncogenic transformation.Mol Cell,2025 Jan 28

图源:10.1016/j.molcel.2025.01.003[1]
近期,Alejandro Gutierrez团队在《Molecular Cell》发表的研究揭示了脂肪肉瘤中关键致癌基因METTL1的非传统作用机制。研究表明,染色体12q13-15扩增通过驱动METTL1过表达促进肿瘤发生,且其致癌功能与甲基转移酶活性无关。实验发现,METTL1的磷酸化形式(S27D)或催化失活突变体能同样激活AKT信号并诱导肉瘤形成,颠覆了此前认为AKT通过磷酸化抑制METTL1活性的认知。机制上,METTL1通过结合多tRNA合成酶复合物,促进tRNA氨基化修饰及蛋白质合成,增强多聚核糖体形成,从而驱动肿瘤细胞增殖。值得注意的是,METTL1扩增的脂肪肉瘤对放线菌素D(核糖体合成抑制剂)高度敏感,提示靶向蛋白质合成通路可能成为有效治疗策略。该研究不仅重新定义了METTL1在癌症中的核心功能,还为开发新型靶向疗法提供了关键分子依据。
03.靶点:CNDP2
应用:肥胖及相关代谢疾病的潜在治疗靶点
来源:A β-hydroxybutyrate shunt pathway generates anti-obesity ketone metabolites.Cell,2025 Jan 09

图源:10.1016/j.cell.2024.10.032[2]
本研究揭示了CNDP2介导的β-羟基丁酸(BHB)次级代谢途径在抗肥胖中的关键作用。研究发现,CNDP2通过酶促反应将BHB与游离氨基酸(如苯丙氨酸)结合,生成具有显著抗肥胖活性的代谢物BHB-氨基酸复合物,其中以BHB-Phe(BHB与苯丙氨酸的结合物)最为丰富。这类代谢物能够特异性激活下丘脑和脑干神经元,抑制食欲并减少食物摄入。实验进一步验证,在小鼠模型中敲除CNDP2基因会降低BHB-氨基酸水平,导致摄食量增加和体重上升;而补充BHB-Phe可有效逆转这一现象。值得注意的是,该代谢途径在人类中高度保守,提示其可能通过调控能量平衡和食欲中枢参与跨物种的体重管理。本研究不仅拓展了BHB在代谢调控中的新功能,还揭示了CNDP2作为潜在靶点在开发肥胖及相关代谢疾病治疗策略中的重要性。
04.靶点:ZDHHC2
应用:结核病的潜在治疗靶点
来源:ZDHHC2 promoted antimycobacterial responses by selective autophagic degradation of B-RAF and C-RAF in macrophages.Sci Adv,2025 Jan 24

图源:10.1126/sciadv.adq7706[3]
本研究发现,结核分枝杆菌感染可诱导小鼠巨噬细胞中锌指DHHC结构域型棕榈酰转移酶(ZDHHC)的表达,尤其是ZDHHC2。ZDHHC2的缺失会削弱巨噬细胞对结核菌的免疫防御能力,降低促炎细胞因子的产生。机制上,ZDHHC2通过介导B-RAF和C-RAF的棕榈酰化,影响其自噬降解,稳定蛋白水平,进而增强ERK信号通路活性,影响结核菌在巨噬细胞内的存活。该研究揭示了ZDHHC2在结核感染中的关键作用,并为结核病治疗提供了潜在靶点。
05.靶点:Casz1
应用:针对感音性耳聋(sensorineural hearing loss)的潜在治疗靶点
来源:Casz1 is required for both inner hair cell fate stabilization and outer hair cell survival.Science,2025 Jan 30

图源:10.1126/science.ado4930[4]
《Science》近期发表的研究揭示了锌指转录因子Casz1在听觉毛细胞(HC)命运稳定与生存维持中的双重作用。研究发现,Casz1在内毛细胞(IHC)中高表达,维持其命运稳定,防止其转变为外毛细胞(OHC);而在OHC中,Casz1短暂表达以维持其存活。Casz1缺失会导致IHC命运不稳定并转变为OHC,同时OHC存活受损,最终导致听力障碍。通过单细胞转录组分析和遗传学回补实验,研究人员发现Gata3是Casz1的关键下游效应分子,Tbx2则对Casz1具有上位调控作用。该研究为听觉毛细胞再生和纤毛功能恢复提供了潜在的基因治疗靶点,有望推动听觉损伤基因治疗的发展。
06.靶点:PELO
应用:携带FOCAD或TTC37突变癌症的潜在抗癌靶点
来源:SKI complex loss renders 9p21.3-deleted or MSI-H cancers dependent on PELO.Nature,2025 Feb 05

评估SKIc缺失作为PELO依赖性的核心机制
图源:10.1038/s41586-024-08509-3[5]
Broad研究所和哥伦比亚大学的研究团队在《Nature》杂志上发表研究,发现PELO基因是约5%成人癌症的潜在抗癌靶点。研究显示,FOCAD或TTC37基因突变的癌细胞严重依赖PELO存活,PELO失活可杀死这些癌细胞。FOCAD和TTC37是“超级杀伤复合体”的一部分,参与从停滞核糖体中提取RNA,而PELO负责重启核糖体。当FOCAD和TTC37突变时,细胞依赖PELO来恢复蛋白质生产,否则会死亡。这一发现为合成致死领域提供了新思路,有望开发针对PELO的靶向药物,为携带FOCAD或TTC37突变的癌症患者提供新的治疗选择。
07.靶点:YAP
应用:HPV阳性的头颈部鳞状细胞癌(HNSC)等的潜在治疗靶点
来源:YAP-driven malignant reprogramming of oral
epithelial stem cells at single cell resolution.Nat Commun,2025 Jan 08

YAP和E6-E7的激活足以在口腔上皮祖细胞(OEPCs)中快速诱导肿瘤发生
图源:10.1038/s41467-024-55660-6[6]
图源:10.1038/s41467-024-55660-6[6]
加州大学圣地亚哥分校的研究团队在《自然-通讯》发表研究,揭示了人乳头瘤病毒(HPV)与转录因子YAP共同作用加速口腔癌发生的新机制。研究发现,HPV的E6和E7促癌蛋白可抑制肿瘤抑制因子,而YAP在口腔上皮祖细胞中异常激活,促使细胞向癌细胞转变,并增加细胞的移动性和侵袭性。在HNSC小鼠模型中,YAP与HPV E6、E7蛋白的共同激活可迅速诱导口腔肿瘤发生,例如小鼠舌部在8天内即可出现肿瘤病变。此外,YAP激活的细胞还会招募并重编程髓系免疫细胞,帮助肿瘤免疫逃逸。研究指出,YAP可能是HPV阳性口腔癌的潜在治疗靶点,团队正在探索阻断YAP功能的药物,如二甲双胍,并开展临床试验验证其效果。
08.靶点:ALKBH5
应用:钙化性主动脉瓣疾病(CAVD)、结直肠癌(CRC)等潜在治疗靶点
来源:The N6-methyladenosine demethylase ALKBH5 is a novel epigenetic regulator of aortic valve calcification.Cardiovasc Res,2024 Dec 10

图源:https://doi.org/10.1093/cvr/cvae253 [7]
广州医科大学朱东兴教授团队在《Cardiovascular Research》发表研究,揭示了m6A去甲基化酶ALKBH5在钙化性主动脉瓣疾病(CAVD)中的关键作用。研究发现,CAVD患者及体外钙化模型中,ALKBH5表达显著下调,而m6A修饰水平升高。ALKBH5通过降低TGFBR2 mRNA的m6A修饰水平,增加其不稳定性并抑制SMAD2磷酸化,从而减轻主动脉瓣间质细胞(VIC)的成骨分化和钙化。此外,ALKBH5还通过调节YTHDF1影响m6A修饰的功能。该研究证实ALKBH5在CAVD中发挥保护作用,有望成为治疗CAVD的潜在靶点。09.靶点:PRDX6
应用:卵巢癌等疾病潜在治疗靶点
来源:PRDX6 Prevents NNMT Ubiquitination and Degradation as a Nonenzymatic Mechanism to Promote Ovarian Cancer Progression.Adv Sci (Weinh),2025 Jan 30

图源: https://doi.org/10.1002/advs.202416484[8]
四川大学华西基础医学与法医学院王魁团队在《Advanced Science》发表研究,揭示了抗氧化酶PRDX6在卵巢癌进展中的非酶活促癌机制。研究发现,PRDX6高表达与卵巢癌患者预后不良相关,且其通过非酶活功能与NNMT竞争性互作,抑制TRIM56介导的NNMT泛素化和蛋白酶体降解,进而上调NNMT蛋白水平。这一过程激活了MAPK信号通路,促进了卵巢癌细胞的生长和转移。在小鼠模型中,PRDX6过表达显著促进肿瘤进展,而NNMT敲低则抑制了这一效应。临床样本分析显示,PRDX6和NNMT的高表达与卵巢癌患者预后更差相关。该研究为卵巢癌治疗提供了新的潜在靶点。
推荐产品
| 靶点 | 重组蛋白 | 货号 |
| FAM171A2 | Recombinant Human Protein FAM171A2 (FAM171A2), partial | CSB-EP008131HU2 |
| ALKBH5 | Recombinant Human Probable alpha-ketoglutarate-dependent dioxygenase ABH5 (ALKBH5) | CSB-EP744062HU |
| CASZ1 | Recombinant Human Zinc finger protein castor homolog 1 (CASZ1), partial | CSB-MP773036HU |
| CNDP2 | Recombinant Human Cytosolic non-specific dipeptidase (CNDP2) | CSB-EP856967HU |
| COL6A3 | Recombinant Human Collagen alpha-3 (VI) chain (COL6A3), partial | CSB-CF005753HUa6 |
| IL18 | Recombinant Human Interleukin-18 (IL18) | CSB-EP614514HU(A4) |
| METTL1 | Recombinant Mouse Interleukin-18 (Il18) | CSB-EP011608MO |
| PELO | Recombinant Dog Interleukin-18 (IL18) | CSB-EP895937DO |
| PRDX6 | Recombinant Human tRNA (guanine-N (7)-)-methyltransferase (METTL1) | CSB-MP880065HU |
参考文献
[1]Neuronal FAM171A2 mediates α-synuclein fibril uptake and drives Parkinson's disease.Science,2025 Feb 21
[2]A methyltransferase-independent role for METTL1 in tRNA aminoacylation and oncogenic transformation.Mol Cell,2025 Jan 28
[3]A β-hydroxybutyrate shunt pathway generates anti-obesity ketone metabolites.Cell,2025 Jan 09
[4]ZDHHC2 promoted antimycobacterial responses by selective autophagic degradation of B-RAF and C-RAF in macrophages.Sci Adv,2025 Jan 24
[5]Casz1 is required for both inner hair cell fate stabilization and outer hair cell survival.Science,2025 Jan 30
[6]SKI complex loss renders 9p21.3-deleted or MSI-H cancers dependent on PELO.Nature,2025 Feb 05
[7]YAP-driven malignant reprogramming of oral
epithelial stem cells at single cell resolution.Nat Commun,2025 Jan 08
[8]The N6-methyladenosine demethylase ALKBH5 is a novel epigenetic regulator of aortic valve calcification.Cardiovasc Res,2024 Dec 10
[9]PRDX6 Prevents NNMT Ubiquitination and Degradation as a Nonenzymatic Mechanism to Promote Ovarian Cancer Progression.Adv Sci (Weinh),2025 Jan 30
*免责声明:华美生物内容团队仅是分享和解读公开研究论文及其发现,本文仅作信息交流,文中观点不代表华美生物立场,请理解。
上一篇: 【28期】前沿靶点速递:每周医学研究精选
下一篇: 【30期】前沿靶点速递:每周医学研究精选










