前沿靶点速递:每周医学研究精选(十八)
日期:2024-11-07 10:23:31
靶点:DLK1
应用:神经母细胞瘤
来源:Hamilton, Amber K., et al. "A proteogenomic surfaceome study identifies DLK1 as an immunotherapeutic target in neuroblastoma." Cancer Cell (2024).
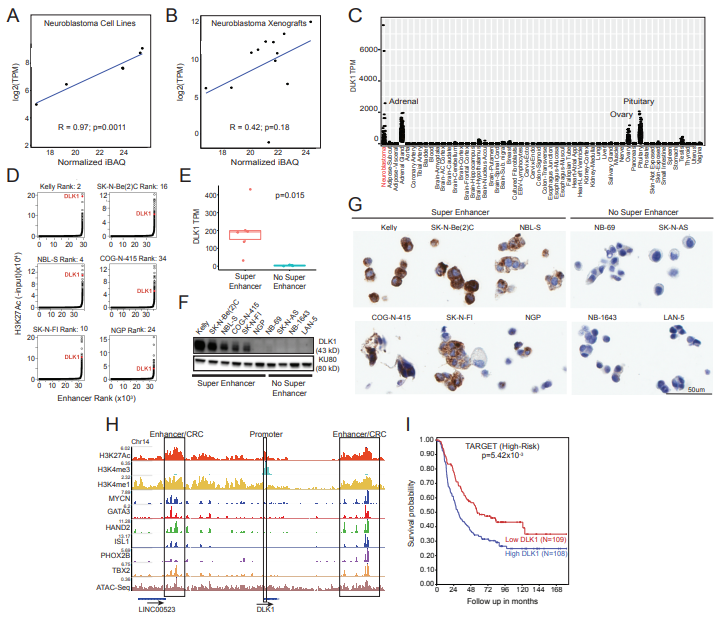
美国费城儿童医院癌症研究中心的Sharon J. Diskin和John M. Maris研究团队在《Cancer Cell》杂志上发表的研究通过整合蛋白质组学、转录组学和表观遗传学数据,鉴定出DLK1(Delta-like canonical notch ligand 1)作为神经母细胞瘤免疫治疗的新靶点。神经母细胞瘤是一种儿童中常见的癌症,目前治疗效果受限于肿瘤的异质性和对化疗药物的耐药性。该研究采用蔗糖梯度离心法富集质膜蛋白,并通过质谱技术鉴定了大量细胞系蛋白和异种移植模型蛋白,筛选出60个候选蛋白,最终确定DLK1作为潜在的免疫治疗靶点。DLK1是一种细胞表面蛋白,参与Notch信号通路,在神经母细胞瘤细胞中高表达,并与MYCN扩增状态相关。研究人员开发的靶向DLK1的抗体药物偶联物(ADCT-701)在神经母细胞瘤异种移植模型中显示出强大的细胞毒性。这项研究为神经母细胞瘤的免疫治疗提供了新的策略和靶点,有望改善高风险患者的治疗结果。
靶点:CTSS
应用:脑衰老与阿尔茨海默病(AD)研究
来源:Liu, Pei‐Pei, et al. "Neuronal cathepsin S increases neuroinflammation and causes cognitive decline via CX3CL1‐CX3CR1 axis and JAK2‐STAT3 pathway in aging and Alzheimer's disease." Aging Cell (2024): e14393.
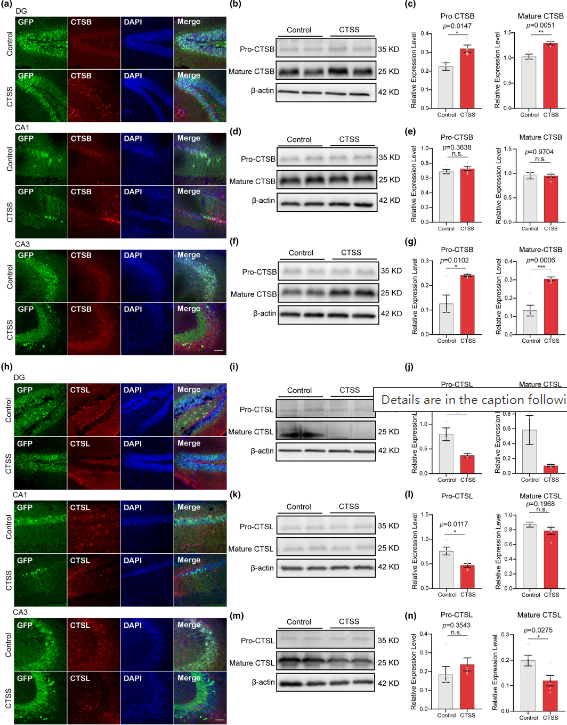
郑州大学第一附属医院刘佩佩副研究员、康建胜教授、任凯迪主管药师以及郑州大学辛永娟博士和汕头大学医学院黄冰教授合作在《Aging Cell》杂志上发表的研究揭示了组织蛋白酶S(CTSS)在脑衰老与阿尔茨海默病(AD)中的关键作用及其分子机制。研究发现,CTSS在衰老小鼠模型海马区神经元中的表达量显著升高,且与小鼠空间学习和记忆行为能力呈负相关,表明其在认知功能衰退中的重要作用。研究还发现,神经元CTSS过表达激活了小胶质细胞向M1型促炎表型的转变,加剧大脑炎症,并通过CX3CL1-CX3CR1轴和JAK2-STAT3信号通路发挥作用。此外,CTSS在AD患者海马和颞皮层中显著高表达,其选择性抑制剂LY3000328能改善APP/PS1小鼠的AD病理特征,为AD治疗提供了新的潜在靶点。该研究不仅为理解CTSS在神经炎症和神经退行性疾病中的功能复杂性提供了新见解,也为脑衰老和AD的早期诊断和治疗提供了新的生物标志物和治疗策略。
靶点:POGK
应用:乳腺癌研究
来源:Tu, Zhenbo, et al. "Tumor-suppressive activities for pogo transposable element derived with KRAB domain via ribosome biogenesis restriction." Molecular Cell (2024).
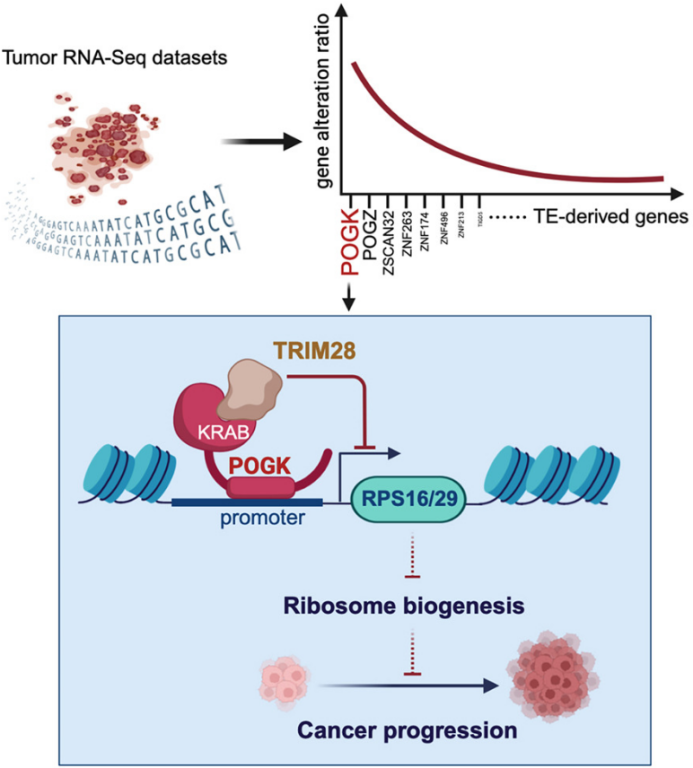
哈佛医学院贝斯以色列女执事医疗中心的Antoine Karnoub团队在《Molecular Cell》上发表的研究揭示了转座元件衍生基因POGK在肿瘤中的关键作用机制。研究发现,POGK是常见肿瘤类型中失调最显著的转座元件衍生基因,特别是在乳腺癌中。POGK通过其KRAB结构域与转录共阻遏物TRIM28结合,直接抑制核心核糖体蛋白的转录,从而全面抑制核糖体生物学功能,限制三阴性乳腺癌细胞的生长。研究还发现POGK在转录后经历转录异构体转换,导致其抑癌作用失活。通过逆转这一转录后异构体转换,POGK有望成为潜在的肿瘤治疗靶点。这项研究不仅阐明了POGK在肿瘤发生与发展中的作用,还强调了转座元件衍生基因在肿瘤生物学中的重要性,并为未来的肿瘤治疗提供了新的策略和靶点。
靶点:SGLT1
应用:骨骼肌相关疾病研究
来源:Huang, Bang‐Bang, et al. "The Impact of SGLT1 Inhibition on Frailty and Sarcopenia: A Mediation Mendelian Randomization Study." Journal of Cachexia, Sarcopenia and Muscle (2024).

福建医科大学附属第一医院的罗莉、谢良地教授团队与张宇杰教授团队合作,在《J Cachexia Sarcopenia Muscle》杂志上发表的研究利用孟德尔随机化方法,揭示了SGLT1抑制对衰弱和肌少症的潜在保护作用。研究团队通过模拟基因预测的SGLT1抑制作用,并结合衰弱指数和低握力的全基因组关联分析数据,发现遗传预测的SGLT1抑制显著降低了衰弱和肌少症的风险,且这一结果在不同诊断标准和性别分层中得到验证。研究还发现胰岛素抵抗在SGLT1抑制对衰弱的保护作用中起到中介作用,而以棕榈酰肉碱为代表的脂质代谢物是SGLT1改善衰弱及肌少症的共同中介。这一发现为理解SGLT1在骨骼肌相关疾病中的作用提供了新见解,并为开发针对衰弱和肌少症的新型治疗策略提供了重要科学依据,有望延缓骨骼肌衰老,改善老年人的生活质量。
靶点:LGALS9、CD44
应用:缺血性卒中研究
来源:Han, Bing, et al. "Integrating spatial and single-cell transcriptomics to characterize the molecular and cellular architecture of the ischemic mouse brain." Science Translational Medicine 16.733 (2024): eadg1323.
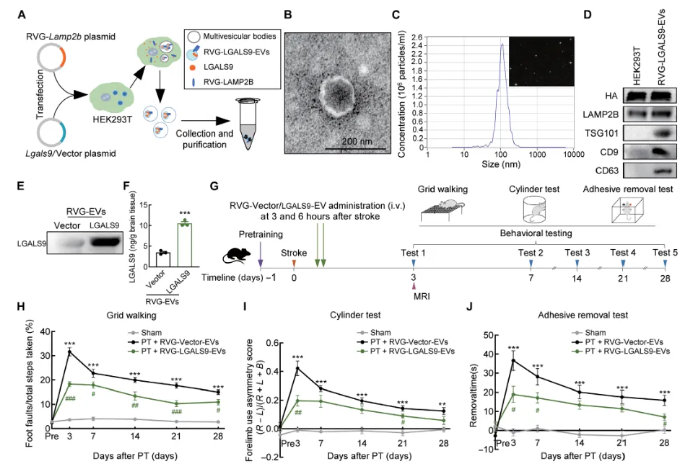
东南大学姚红红教授团队在《Science Translational Medicine》上发表的研究揭示了LGALS9-CD44信号通路在卒中后脑修复中的重要作用。通过空间转录组测序和单细胞转录组测序,研究者们详细解析了缺血性卒中模型小鼠大脑的基因表达和细胞特征,发现细胞外囊泡介导的LGALS9-CD44信号通路在促进卒中后脑修复中起到关键作用。研究指出,小胶质细胞和巨噬细胞是卒中后半乳糖凝集素的主要来源,而LGALS9的传递通过改善小鼠的长期功能恢复,表明Lgals9是一个潜在的治疗靶点。此外,研究还发现CD44介导LGALS9在抑制缺血诱导的星形胶质细胞活化中的功能,并且LGALS9-CD44相互作用促进了中风后的髓鞘再生。这些发现为中风治疗提供了新的分子机制和治疗策略。
靶点:NLRP10
应用:特应性皮炎研究
来源:Cho, Yeonhee, et al. "NLRP10 maintains epidermal homeostasis by promoting keratinocyte survival and P63-dependent differentiation and barrier function." Cell Death & Disease 15.10 (2024): 759.
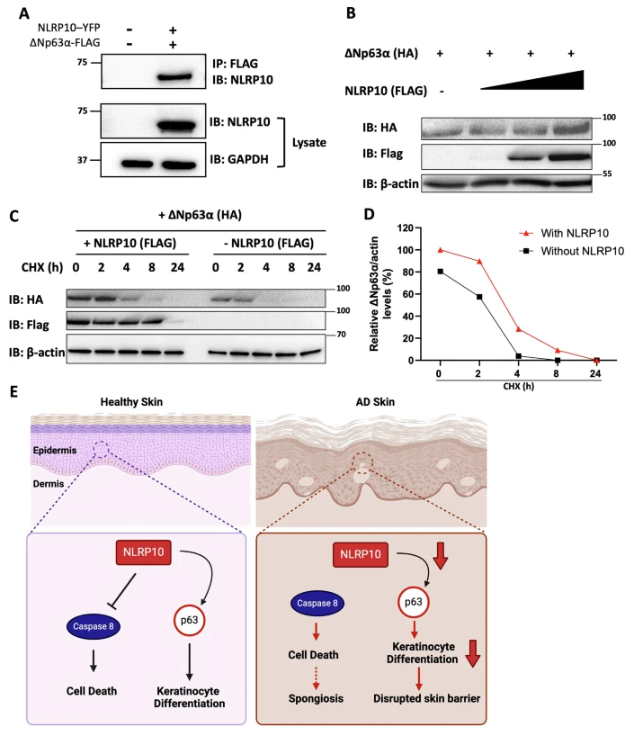
美国安进公司炎症研究部门周毅团队在《Cell Death & Disease》期刊上发表的研究揭示了NLRP10在特应性皮炎(AD)中的潜在治疗作用。研究发现,NLRP10在AD皮肤样本中表达下调,且在人体皮肤等效培养体系中促进角质形成细胞存活,对表皮分化和屏障功能至关重要。从机制上讲,NLRP10通过阻止Caspase-8募集到死亡诱导信号复合物(DISC)并抑制其激活来限制细胞死亡,同时稳定角质形成细胞分化的主要调节因子p63,驱动角质形成细胞的适当分化并增强屏障功能。这些发现强调了NLRP10在AD发病机制中的关键作用,并将其作为恢复皮肤屏障功能和稳态治疗AD的潜在靶点。靶向NLRP10的治疗药物可能成为恢复表皮功能的有效方法,与当前免疫调节疗法互补,以实现更强的临床效益。
靶点:KDM5C 和 YY1
应用:肿瘤研究
来源:Zheng, Qian, et al. "Targeting the transcription factor YY1 is synthetic lethal with loss of the histone demethylase KDM5C." EMBO reports (2024): 1-21.
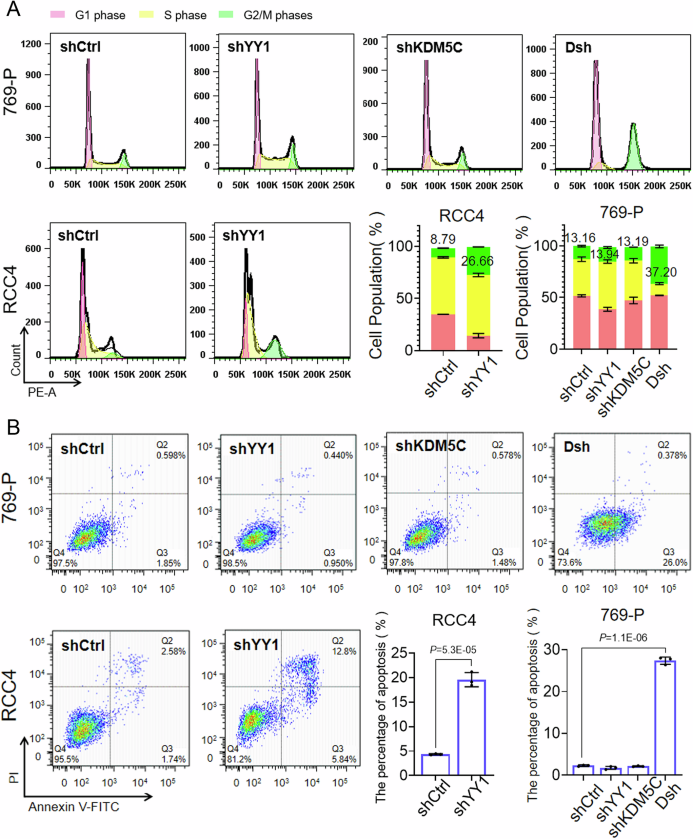
武汉大学泰康医学院的李枫和熊洁课题组在《EMBO Reports》期刊上发表的研究揭示了组蛋白去甲基化酶KDM5C与转录因子YY1之间的新型蛋白质相互作用,并发现这一互作对于肿瘤细胞的生存至关重要。研究团队通过整合蛋白质组学和功能基因组学分析,发现KDM5C能够招募YY1并增加其在基因组中的富集,而且这一过程不依赖于KDM5C的去甲基化酶活性。在细胞和动物模型中,KDM5C基因突变或表达降低的肿瘤细胞对YY1的缺失更加敏感,表明KDM5C和YY1构成合成致死基因对。这一发现不仅揭示了表观遗传因子KDM5C调控转录的新机制,也为基于合成致死原理的肿瘤靶向治疗提供了新的生物标志物和治疗策略,有助于开发个体化治疗方案,推动肿瘤治疗领域的发展。
靶点:IRGQ
应用:肝细胞癌研究
来源:Herhaus, Lina, et al. "IRGQ-mediated autophagy in MHC class I quality control promotes tumor immune evasion." Cell (2024).

德国法兰克福大学的Ivan Dikic团队在《Cell》杂志上发表了一项研究,揭示了免疫相关GTP酶家族Q(IRGQ)在肿瘤免疫逃逸中的新角色。研究发现,IRGQ作为一种新型自噬受体,通过与GABARAPL2和LC3B的相互作用,参与MHC I类分子的质量控制,进而影响其表达并促进肿瘤细胞的免疫逃逸。实验结果表明,IRGQ缺失会导致MHC I类分子在细胞内积累,增强CD8+ T细胞的免疫反应,从而限制肿瘤的生长。此外,IRGQ在肝细胞癌(HCC)中高表达与MHC I类基因低表达相关,并与患者生存时间缩短有关。通过小鼠模型研究,IRGQ基因敲除的小鼠显示出更长的生存时间和减轻的肿瘤负担,表明IRGQ在HCC免疫逃逸中的重要性。这项研究不仅增进了对IRGQ在自噬过程中的功能理解,也为肿瘤免疫治疗提供了新的潜在靶点,强调了调节IRGQ水平可能提高患者免疫反应和生存率的前景。
参考文献
1. Hamilton, Amber K., et al. "A proteogenomic surfaceome study identifies DLK1 as an immunotherapeutic target in neuroblastoma." Cancer Cell (2024).
2. Liu, Pei‐Pei, et al. "Neuronal cathepsin S increases neuroinflammation and causes cognitive decline via CX3CL1‐CX3CR1 axis and JAK2‐STAT3 pathway in aging and Alzheimer's disease." Aging Cell (2024): e14393.
3. Tu, Zhenbo, et al. "Tumor-suppressive activities for pogo transposable element derived with KRAB domain via ribosome biogenesis restriction." Molecular Cell (2024).
4. Huang, Bang‐Bang, et al. "The Impact of SGLT1 Inhibition on Frailty and Sarcopenia: A Mediation Mendelian Randomization Study." Journal of Cachexia, Sarcopenia and Muscle (2024).
5. Han, Bing, et al. "Integrating spatial and single-cell transcriptomics to characterize the molecular and cellular architecture of the ischemic mouse brain." Science Translational Medicine 16.733 (2024): eadg1323.
6. Cho, Yeonhee, et al. "NLRP10 maintains epidermal homeostasis by promoting keratinocyte survival and P63-dependent differentiation and barrier function." Cell Death & Disease 15.10 (2024): 759.
7. Zheng, Qian, et al. "Targeting the transcription factor YY1 is synthetic lethal with loss of the histone demethylase KDM5C." EMBO reports (2024): 1-21.
8. Herhaus, Lina, et al. "IRGQ-mediated autophagy in MHC class I quality control promotes tumor immune evasion." Cell (2024).
应用:神经母细胞瘤
来源:Hamilton, Amber K., et al. "A proteogenomic surfaceome study identifies DLK1 as an immunotherapeutic target in neuroblastoma." Cancer Cell (2024).

(图源:DLK1优先作为神经母细胞瘤候选免疫治疗靶点 [1])
美国费城儿童医院癌症研究中心的Sharon J. Diskin和John M. Maris研究团队在《Cancer Cell》杂志上发表的研究通过整合蛋白质组学、转录组学和表观遗传学数据,鉴定出DLK1(Delta-like canonical notch ligand 1)作为神经母细胞瘤免疫治疗的新靶点。神经母细胞瘤是一种儿童中常见的癌症,目前治疗效果受限于肿瘤的异质性和对化疗药物的耐药性。该研究采用蔗糖梯度离心法富集质膜蛋白,并通过质谱技术鉴定了大量细胞系蛋白和异种移植模型蛋白,筛选出60个候选蛋白,最终确定DLK1作为潜在的免疫治疗靶点。DLK1是一种细胞表面蛋白,参与Notch信号通路,在神经母细胞瘤细胞中高表达,并与MYCN扩增状态相关。研究人员开发的靶向DLK1的抗体药物偶联物(ADCT-701)在神经母细胞瘤异种移植模型中显示出强大的细胞毒性。这项研究为神经母细胞瘤的免疫治疗提供了新的策略和靶点,有望改善高风险患者的治疗结果。
靶点:CTSS
应用:脑衰老与阿尔茨海默病(AD)研究
来源:Liu, Pei‐Pei, et al. "Neuronal cathepsin S increases neuroinflammation and causes cognitive decline via CX3CL1‐CX3CR1 axis and JAK2‐STAT3 pathway in aging and Alzheimer's disease." Aging Cell (2024): e14393.

(图源:神经元 CTSS 过表达增加小胶质细胞中的组织蛋白酶 B (CTSB) 活性 [2])
郑州大学第一附属医院刘佩佩副研究员、康建胜教授、任凯迪主管药师以及郑州大学辛永娟博士和汕头大学医学院黄冰教授合作在《Aging Cell》杂志上发表的研究揭示了组织蛋白酶S(CTSS)在脑衰老与阿尔茨海默病(AD)中的关键作用及其分子机制。研究发现,CTSS在衰老小鼠模型海马区神经元中的表达量显著升高,且与小鼠空间学习和记忆行为能力呈负相关,表明其在认知功能衰退中的重要作用。研究还发现,神经元CTSS过表达激活了小胶质细胞向M1型促炎表型的转变,加剧大脑炎症,并通过CX3CL1-CX3CR1轴和JAK2-STAT3信号通路发挥作用。此外,CTSS在AD患者海马和颞皮层中显著高表达,其选择性抑制剂LY3000328能改善APP/PS1小鼠的AD病理特征,为AD治疗提供了新的潜在靶点。该研究不仅为理解CTSS在神经炎症和神经退行性疾病中的功能复杂性提供了新见解,也为脑衰老和AD的早期诊断和治疗提供了新的生物标志物和治疗策略。
靶点:POGK
应用:乳腺癌研究
来源:Tu, Zhenbo, et al. "Tumor-suppressive activities for pogo transposable element derived with KRAB domain via ribosome biogenesis restriction." Molecular Cell (2024).

(图源:转座元件衍生基因POGK在肿瘤中的关键作用机制 [3])
哈佛医学院贝斯以色列女执事医疗中心的Antoine Karnoub团队在《Molecular Cell》上发表的研究揭示了转座元件衍生基因POGK在肿瘤中的关键作用机制。研究发现,POGK是常见肿瘤类型中失调最显著的转座元件衍生基因,特别是在乳腺癌中。POGK通过其KRAB结构域与转录共阻遏物TRIM28结合,直接抑制核心核糖体蛋白的转录,从而全面抑制核糖体生物学功能,限制三阴性乳腺癌细胞的生长。研究还发现POGK在转录后经历转录异构体转换,导致其抑癌作用失活。通过逆转这一转录后异构体转换,POGK有望成为潜在的肿瘤治疗靶点。这项研究不仅阐明了POGK在肿瘤发生与发展中的作用,还强调了转座元件衍生基因在肿瘤生物学中的重要性,并为未来的肿瘤治疗提供了新的策略和靶点。
靶点:SGLT1
应用:骨骼肌相关疾病研究
来源:Huang, Bang‐Bang, et al. "The Impact of SGLT1 Inhibition on Frailty and Sarcopenia: A Mediation Mendelian Randomization Study." Journal of Cachexia, Sarcopenia and Muscle (2024).

(图源:doi.org/10.1002/jcsm.13614 [4])
福建医科大学附属第一医院的罗莉、谢良地教授团队与张宇杰教授团队合作,在《J Cachexia Sarcopenia Muscle》杂志上发表的研究利用孟德尔随机化方法,揭示了SGLT1抑制对衰弱和肌少症的潜在保护作用。研究团队通过模拟基因预测的SGLT1抑制作用,并结合衰弱指数和低握力的全基因组关联分析数据,发现遗传预测的SGLT1抑制显著降低了衰弱和肌少症的风险,且这一结果在不同诊断标准和性别分层中得到验证。研究还发现胰岛素抵抗在SGLT1抑制对衰弱的保护作用中起到中介作用,而以棕榈酰肉碱为代表的脂质代谢物是SGLT1改善衰弱及肌少症的共同中介。这一发现为理解SGLT1在骨骼肌相关疾病中的作用提供了新见解,并为开发针对衰弱和肌少症的新型治疗策略提供了重要科学依据,有望延缓骨骼肌衰老,改善老年人的生活质量。
靶点:LGALS9、CD44
应用:缺血性卒中研究
来源:Han, Bing, et al. "Integrating spatial and single-cell transcriptomics to characterize the molecular and cellular architecture of the ischemic mouse brain." Science Translational Medicine 16.733 (2024): eadg1323.

(图源:含有 LGALS9 的工程化细胞外囊泡 (EV) 促进中风小鼠感觉和运动功能的恢复 [5])
东南大学姚红红教授团队在《Science Translational Medicine》上发表的研究揭示了LGALS9-CD44信号通路在卒中后脑修复中的重要作用。通过空间转录组测序和单细胞转录组测序,研究者们详细解析了缺血性卒中模型小鼠大脑的基因表达和细胞特征,发现细胞外囊泡介导的LGALS9-CD44信号通路在促进卒中后脑修复中起到关键作用。研究指出,小胶质细胞和巨噬细胞是卒中后半乳糖凝集素的主要来源,而LGALS9的传递通过改善小鼠的长期功能恢复,表明Lgals9是一个潜在的治疗靶点。此外,研究还发现CD44介导LGALS9在抑制缺血诱导的星形胶质细胞活化中的功能,并且LGALS9-CD44相互作用促进了中风后的髓鞘再生。这些发现为中风治疗提供了新的分子机制和治疗策略。
靶点:NLRP10
应用:特应性皮炎研究
来源:Cho, Yeonhee, et al. "NLRP10 maintains epidermal homeostasis by promoting keratinocyte survival and P63-dependent differentiation and barrier function." Cell Death & Disease 15.10 (2024): 759.

(图源:NLRP10 稳定角质形成细胞中的 p63 [6])
美国安进公司炎症研究部门周毅团队在《Cell Death & Disease》期刊上发表的研究揭示了NLRP10在特应性皮炎(AD)中的潜在治疗作用。研究发现,NLRP10在AD皮肤样本中表达下调,且在人体皮肤等效培养体系中促进角质形成细胞存活,对表皮分化和屏障功能至关重要。从机制上讲,NLRP10通过阻止Caspase-8募集到死亡诱导信号复合物(DISC)并抑制其激活来限制细胞死亡,同时稳定角质形成细胞分化的主要调节因子p63,驱动角质形成细胞的适当分化并增强屏障功能。这些发现强调了NLRP10在AD发病机制中的关键作用,并将其作为恢复皮肤屏障功能和稳态治疗AD的潜在靶点。靶向NLRP10的治疗药物可能成为恢复表皮功能的有效方法,与当前免疫调节疗法互补,以实现更强的临床效益。
靶点:KDM5C 和 YY1
应用:肿瘤研究
来源:Zheng, Qian, et al. "Targeting the transcription factor YY1 is synthetic lethal with loss of the histone demethylase KDM5C." EMBO reports (2024): 1-21.

(图源:KDM5C 和 YY1 同时丢失促进细胞周期停滞和细胞凋亡 [7])
武汉大学泰康医学院的李枫和熊洁课题组在《EMBO Reports》期刊上发表的研究揭示了组蛋白去甲基化酶KDM5C与转录因子YY1之间的新型蛋白质相互作用,并发现这一互作对于肿瘤细胞的生存至关重要。研究团队通过整合蛋白质组学和功能基因组学分析,发现KDM5C能够招募YY1并增加其在基因组中的富集,而且这一过程不依赖于KDM5C的去甲基化酶活性。在细胞和动物模型中,KDM5C基因突变或表达降低的肿瘤细胞对YY1的缺失更加敏感,表明KDM5C和YY1构成合成致死基因对。这一发现不仅揭示了表观遗传因子KDM5C调控转录的新机制,也为基于合成致死原理的肿瘤靶向治疗提供了新的生物标志物和治疗策略,有助于开发个体化治疗方案,推动肿瘤治疗领域的发展。
靶点:IRGQ
应用:肝细胞癌研究
来源:Herhaus, Lina, et al. "IRGQ-mediated autophagy in MHC class I quality control promotes tumor immune evasion." Cell (2024).

(图源:IRGQ 调节人和鼠肝细胞癌中的 CD8+ T 细胞反应 [8])
德国法兰克福大学的Ivan Dikic团队在《Cell》杂志上发表了一项研究,揭示了免疫相关GTP酶家族Q(IRGQ)在肿瘤免疫逃逸中的新角色。研究发现,IRGQ作为一种新型自噬受体,通过与GABARAPL2和LC3B的相互作用,参与MHC I类分子的质量控制,进而影响其表达并促进肿瘤细胞的免疫逃逸。实验结果表明,IRGQ缺失会导致MHC I类分子在细胞内积累,增强CD8+ T细胞的免疫反应,从而限制肿瘤的生长。此外,IRGQ在肝细胞癌(HCC)中高表达与MHC I类基因低表达相关,并与患者生存时间缩短有关。通过小鼠模型研究,IRGQ基因敲除的小鼠显示出更长的生存时间和减轻的肿瘤负担,表明IRGQ在HCC免疫逃逸中的重要性。这项研究不仅增进了对IRGQ在自噬过程中的功能理解,也为肿瘤免疫治疗提供了新的潜在靶点,强调了调节IRGQ水平可能提高患者免疫反应和生存率的前景。
参考文献
1. Hamilton, Amber K., et al. "A proteogenomic surfaceome study identifies DLK1 as an immunotherapeutic target in neuroblastoma." Cancer Cell (2024).
2. Liu, Pei‐Pei, et al. "Neuronal cathepsin S increases neuroinflammation and causes cognitive decline via CX3CL1‐CX3CR1 axis and JAK2‐STAT3 pathway in aging and Alzheimer's disease." Aging Cell (2024): e14393.
3. Tu, Zhenbo, et al. "Tumor-suppressive activities for pogo transposable element derived with KRAB domain via ribosome biogenesis restriction." Molecular Cell (2024).
4. Huang, Bang‐Bang, et al. "The Impact of SGLT1 Inhibition on Frailty and Sarcopenia: A Mediation Mendelian Randomization Study." Journal of Cachexia, Sarcopenia and Muscle (2024).
5. Han, Bing, et al. "Integrating spatial and single-cell transcriptomics to characterize the molecular and cellular architecture of the ischemic mouse brain." Science Translational Medicine 16.733 (2024): eadg1323.
6. Cho, Yeonhee, et al. "NLRP10 maintains epidermal homeostasis by promoting keratinocyte survival and P63-dependent differentiation and barrier function." Cell Death & Disease 15.10 (2024): 759.
7. Zheng, Qian, et al. "Targeting the transcription factor YY1 is synthetic lethal with loss of the histone demethylase KDM5C." EMBO reports (2024): 1-21.
8. Herhaus, Lina, et al. "IRGQ-mediated autophagy in MHC class I quality control promotes tumor immune evasion." Cell (2024).










